创新医疗器械特别审查VS医疗器械优先审批:上市快速通道怎么选?
发布时间:2025-04-27 16:56:52
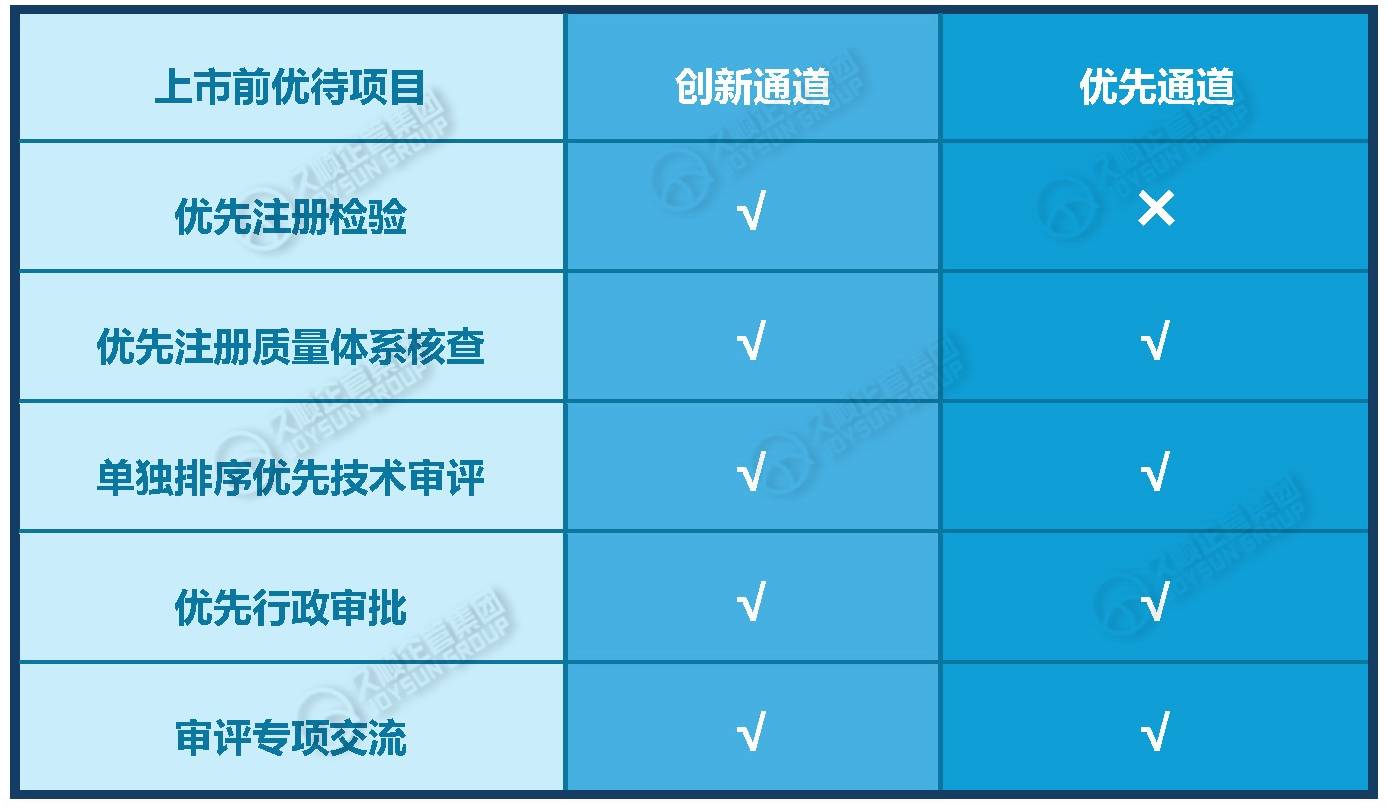
“医疗器械优先审批”和“创新医疗器械特别审批”同为国内医疗器械产品快速上市的通道,但两者在
1.创新医疗器械特别审查(“创新通道”):聚焦技术原创性/突破性,旨在保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展。
2.优先审批(“优先通道”):聚焦临床需求,旨在保障存在供应短缺或具有明显临床优势的医疗器械的临床使用需求。

省级药品监督管理部门初审(20个工作日),威廉希尔APP威廉希尔APP若不符合则会告知申请人,若符合则将申报资料和初审意见报送国家药品监督管理局医疗器械技术审评中心。
·国家药品监督管理局医疗器械技术审评中心设立创新医疗器械审查办公室,组织专家进行审查(60个工作日)。
·对优先审批申请材料齐全的且予以受理的注册申请项目,注明优先审批申请并转交技术审评中心;
·器审中心每月集中组织专家论证审核,出具审核意见。经专家论证需要优先审批的,拟定予以优先审批(对列入国家科技重大专项或国家重点研发计划的医疗器械,器审中心自收到申请之日起5个工作日内进行审核,符合优先审批情形的,拟定予以优先审批);
·创新通道更适合:技术突破性强、研发风险高的项目,需早期与药监部门沟通优化方案。
案例--新冠检测试剂(2020年通过优先通道紧急获批)。返回搜狐,查看更多

